对于不良事件(AE)与药物之间的相关性判断,目前全球存在30多种判断规则以及不同的评判结果分类,并没有统一的标准。在国内的临床研究中,研究者习惯采用“5分法”记录和报告严重不良事件(SAE),而申办者需要判断事件是否符合“可疑且非预期严重不良反应(SUSAR)”,采用的是“2分法”。两种判断的异同和解决方案成为CQAF-PV工作组的第一期“PV线上小讨论”的主题(2022年3月30日)。本期小讨论由勃林格殷格翰的吴奕卿女士主持,邀请到上海市精神卫生中心机构办沈一峰主任,拜耳亚太区稽查负责人于桂琴女士和百济神州药物警戒高级总监张轶菁女士参与讨论。
嘉宾热议
合理性和必要性
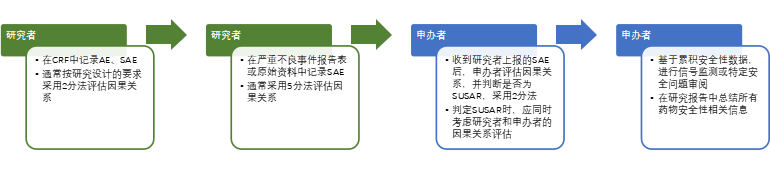
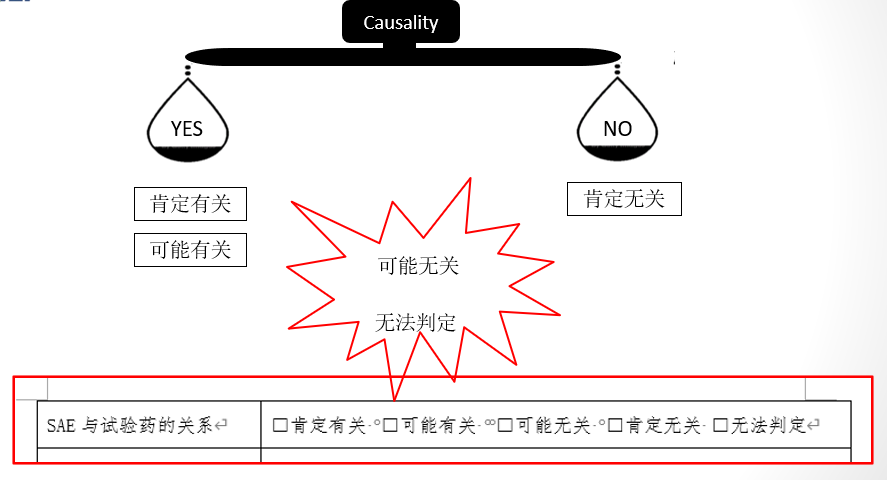
2004年国家药监局颁布了《药物研究监督管理办法(试行)》,所附的严重不良事件报告表至今仍在一些研究中心被沿用。其中SAE与试验药物的关系判断采用5分法填报,即肯定有关、可能有关、可能无关、肯定无关和无法判断。虽然目前《药物研究监督管理办法(试行)》已被新法取代,但从临床研究机构的角度来说,“5分法”使用多年,大多数临床研究中心已经形成规范。针对个例的评估,研究者基于研究药物现有信息和患者临床实际情况,综合考虑不确定因素,习惯使用“5分法”记录。
2020年7月1日《药物临床试验质量管理规范(GCP)》正式实施,规定研究者应当向申办者书面报告所有严重不良事件,申办者应当向药品监督管理部门和卫生健康主管部门报告SUSAR。按ICH指导原则,必须以“是“和”否“的清晰结论来判断SUSAR加速报告的要求。此外从药物警戒的角度来看,申办者须参考研究者对个例报告的分析来评估信号证据等级强度,并结合药物累积数据进行信号检测以及对特定安全问题审阅,综合评价药物的风险并决定是否采取相应的风险管控行动。
综上所述,“2分法”是为满足向监管部门报告的要求,而“5分法”更多出于医学和科学分析的考量,尝试判断和量化因果关联的可能性。这两种标准在一段时间内仍会并存。
现实工作中的“冲突”
部分2020年7月以前开展的临床试验中,原始文件与CRF都以5分法记录,这就要求申办者将收集到的报告再次判断,以决定是否需要个例SUSAR的快速报告。另一种情况是研究者在原始记录中按患者临床情况判断,可能在一定时间内无法给予肯定结论,但CRF要求以2分法记录,此时研究者需要做出2种判断。判断过程中就会产生一些疑问,怎样的判断才是合理的,到底这两种判断标准应该如何对应,是否有统一的标准?
冲突焦点-“可能无关”的归属
临床试验各方职责和关注点不同,对于申办者,明确“是”或“否”是识别SUSAR、进行快速报告的必要条件。而研究者在信息有限的情况下,尤其是在早期研究或创新药物安全特征不很明确时,从保护受试者的原则出发,往往给出“可能相关”的判断。
评估AE与研究治疗的关系时需考虑的重要因素包括与给药的时间顺序、停药(去激发)后AE恢复、再次用药(再激发)后复发、基础疾病、合并治疗、药物的药理学特征等。如果AE发生在用药后,存在时间上的关联,相比“肯定无关”,如果没有其他确凿的导致AE的因素,部分研究者会倾向做“可能无关”的判断。这部分“可能无关”的病例从严归类为“有关”,一方面,引起申办者以及监管部门的关注,从长远看,对药物安全性信息全貌的完善更有意义,对保护患者有利。另一方面,从严归类让过多可能无关报告进入快速报告流程,也可能占用监测和审评资源。
可能的解决方案
1. 文件支持
建议申办者提前与各研究中心基于研发产品的药物特性、研究阶段、试验样本量大小等因素就相关性评估的要求和考虑因素,以及2种评估标准之间的对应操作原则进行沟通,达成一致,并将双方沟通的结果记录在研究文件或研究方案中,以便于研究者在同一个临床试验项目中按相对一致的标准执行。对于实践中可能出现的特殊案例,可以单独沟通或会议决定,同时做好书面记录。
2. 从严“保守”
为保障受试者安全,申办者和研究者在相关性判断上都应遵循从严处置的原则--即不能完全排除药物相关性时,则判定为有关,尤其对安全特征尚不明朗的创新药。随着临床试验的开展,申办者根据新的数据及时更新IB,推出阶段性报告,加强各方对药物安全性的深入认识,促进对药物相关性做出科学合理的判断。
3. 分工协作
临床试验中保护受试者的权益和安全,是研究者、伦理委员会、机构办和申办者的共同责任。研究者充分收集安全性相关信息,通过审慎分析判断实现对每一名受试者的安全保障;伦理委员会更加关注未知风险,SUSAR报告的审查非常重要,因为可能会改变首次伦理审查时被接受的风险/获益比。机构办除了接收SUSAR报告和存档,重点在于培训和确认一线研究人员学会如何开展相关工作,保证院内流程的顺畅和高效。
申办者通过对产品安全性信息持续收集和分析达到对产品安全性认知的不断深入,并需要符合各方面法律法规的要求。严谨负责的申办者会通过清晰的标准、完善的操作流程、工作一致性为临床试验和受试者带来安全保障。
总结
不同申办者和研究中心对于不良事件与药物之间的相关性判断可能采用不同的标准,针对受试者个体事件的相关性判断的主要权责在研究者,针对研发药品的安全性信息收集和报告主要权责在申办者。两方的关注点虽然不完全一致,通过互相之间密切配合和合作,可以科学探索研发药品的安全特性,最大程度保障受试者安全。
参考文献
1.《药物临床试验质量管理规范》,2020年7月1日
2.《药物临床试验期间安全性数据快速报告标准和程序》,2018年5月1日
3.《药物临床试验期间安全性数据快速报告常见问答(1.0)版》,2019年4月11日
4. ICH E2A: CLINICAL SAFETY DATA MANAGEMENT: DEFINITIONS AND STANDARDS FOR EXPEDITED REPORTING E2A
5. 药物临床试验安全评价广东共识(2020年版)
-----------------------------------------------------------------------
作者:王静
审阅:沈一峰 于桂琴 张轶菁 吴奕卿
声明: 本文内容反映CQAF当前观点,供业内同仁互相学习交流。
药物警戒质量相关问题请点击下方二维码提交


 沪公网安备 31011202013414号
沪公网安备 31011202013414号