药物警戒审计(亦称 “内部审核”、“内审”、“稽查“”)是质量管理的重要一环,是评估药物警戒体系及其质量体系的适宜性、充分性、有效性的重要方式1。审计人员独立于药物警戒部门之外,能更客观、系统、全面地审查药物警戒相关制度、规程及其执行情况。审计不仅可以发现质量问题,促进持续改进;同时也可以验证现有体系的适宜性、充分性和有效性,以保障全面符合相关法律法规的要求。
另外,欧盟及中国的《药物警戒质量管理规范》均要求:药品上市许可持有人(以下简称持有人)应定期开展药物警戒内审1,2。根据我国药监机构2022年4月发布的《药物警戒检查指导原则》,若持有人未定期对药物警戒体系及活动开展内审,可判定为严重缺陷3。
本文主要分享药物警戒审计的主要类型及基于风险的年度审计计划。针对单个药物警戒审计的计划、实施和报告流程及其最佳实践,敬请期待后续分享。
一、药物警戒审计的类型及目的
药物警戒审计通常可以分为药物警戒体系/流程审计、分公司审计(针对于大型集团公司或跨国公司)、药物警戒供应商审计及许可证合作方审计。通常每类审计的目的如下:
药物警戒体系/流程审计:针对药物警戒体系或某一关键药物警戒流程的审计,以评估药物警戒体系或流程是否满足相关法规和公司规程的要求。流程审计通常涵盖从起点到终点的全流程活动,包括相关流程文件的制定及维护、人员培训、流程的实施及合规监控等。如果该流程中用到计算机系统,则应包括对该系统的审查。例如药物安全信号管理流程的审计,应涵盖:1)多种来源的信号检测(包括来自监管机构、基于安全数据库的定期分析、文献检索等)2)信号验证 3)信号优先排序 4)信号评估 5)基于评估结果采取的相关措施 6)用于信号检测的计算机系统等。流程审计也可能根据风险评估和数据分析的结果重点关注其中的某个/某些环节,如仅审查信号检测的环节。
分公司审计:涵盖指定区域或子公司所有的药物警戒活动及其质量管理体系,以评估其药物警戒体系是否符合当地法规及公司内部的要求。除药物警戒部门,其他部门若参与到药物警戒活动中,也可能纳入审计范围,如医学部、临床研究部、销售部、市场部、生产质量部等。
药物警戒供应商审计:基于与供应商的协议,评估供应商的履责情况。
许可证合作方审计:基于双方签订的药物警戒协议,评估合作方履责情况。
二、 基于风险的药物警戒审计计划
药物警戒审计应涵盖所有药物警戒活动及其质量管理体系,包括与公司内外部相关方的合作以及与监管部门的沟通,并基于风险评估的结果来制定审计计划(通常为年度计划或更长久的策略规划)。
其中风险评估可以考虑的因素包括但不仅限于:
• 国内外药物警戒法规和指南的变更。
• 组织机构、人员、流程的变化:重大的组织机构重组(如公司合并、并购等),关键管理层的变化,有经验的药物警戒人员数量的减少,相关支持部门(例如信息部门)的变化,药物警戒关键流程的变更等。
• 安全数据库的重大变更:引入新的数据库或已有数据库的重大升级,例如基于中国E2B(R3)电子传输要求进行的安全数据库的升级。
• 产品的特性:是否为该持有人第一个上市的产品,是否需要实施风险最小化措施或其他的安全性承诺。此外,还需综合考虑产品的市场覆盖、销售情况、投诉情况等。
• 业务的关键性:评估该业务是否会极大影响药物警戒体系的正常运行。例如相对于市场调研的供应商,负责信号检测和定期安全性报告撰写的供应商的风险水平会更高。
• 既往药监机构检查或公司内审的结果:既往(如最近三年)是否有监管检查、公司内审,以及之前的检查、内审是否有严重缺陷和主要缺陷等。
• 是否在日常工作中,业务部门已发现了某流程存在缺陷、药物警戒合规指标是否已出现了异常等。
• 其他因素,如相关方和管理层的意见和建议,包括药物警戒负责人的建议。
以上的风险因素,应按照以下三个方面进行风险的综合评估:
• 事件发生的可能性
• 问题出现后,其影响的严重程度(对于药物警戒来说,最重要的考量是对患者和公共安全的影响)
• 该风险被监测到的可能性
根据具体的情况,建议赋予以上三个维度不同的分值(如0,5,10,20),最后将三个维度的风险得分相乘,从而得到对每一个审计对象(如某流程,分公司,合作方,供应商等)的风险总分值。根据风险总分值的高低,确定审计对象并制定年度的药物警戒审计计划。
最后,审计计划需要获得管理层的审阅和批准,也需要提前与相关部门及团队进行沟通。
三、常见的药物警戒检查发现
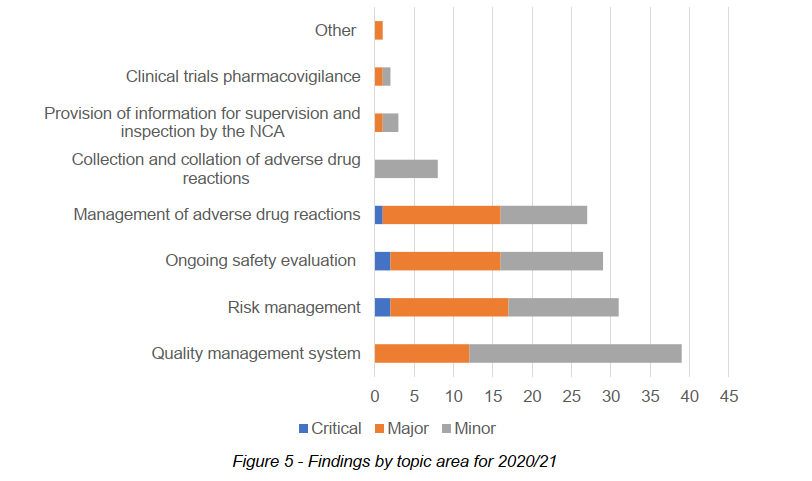
基于2020-2021年度MHRA(英国药品与健康产品管理局)药物警戒检查报告,质量管理体系方面的问题数量最多,而其中大部分与药物警戒内审相关,如:没有审计策略或基于风险的审计计划、审计计划中未涵盖关键的药物警戒流程、审计报告发布延迟导致问题分析及整改延迟等4。
参考文献
1. 《中国药物警戒质量管理规范》,2021年5月
2. GVP Module IV- Pharmacovigilance Audit (R1), 2014年9月16日
3. 《中国药物警戒检查指导原则》, 2022年4月
4. MHRA PV Inspection Metrics Report(April 2020 – March 2021)
作者:周艺
审阅:吴奕卿 刘清月 徐晓刚
药物警戒质量相关问题,请点击下方二维码提交


 沪公网安备 31011202013414号
沪公网安备 31011202013414号