质量管理体系的基本考虑合规的、适合的、有机的,才是最好的
质量管理的底线是合规。在进行体系设计时,其框架应能覆盖法规要求的范围,并确保组织流程及业务活动合规。如药物警戒活动相关部门的定位及协作,人员资质及培训要求,基本的规程制度,对外包业务的监督管理等。
质量管理体系没有最好,只有最合适。“拿来”的体系并不一定能发挥其应有的作用,除了造成不必要的资源浪费之外,甚至可能因为“水土不服”而导致不合规。同时,组织在不同的发展阶段,其质量管理体系的特点也是随之变化的,故应合理配置符合企业规模、发展阶段及发展需求的质量管理体系。一个合适的质量管理体系,应与持有人的类型、规模、持有品种的数量及安全性特征等相适应。以下是一些例子,
若组织尚未有产品上市,药物警戒活动仅限于药品注册申请人和相关临床试验活动,那么当下药物警戒体系和质量管理,应当与实际临床试验期间的药物警戒活动相匹配;
若组织已对外委托开展药物警戒活动,则质量管理体系的设计应重点考虑外部供应商或合作方的管理和审核,确保受托方的体系符合要求;
若组织内部有多个药物警戒团队,比如全球部门和各分支国家部门,在体系设计时,应考虑不同团队的责任分工及有效协作;
若组织内部有其他团队(如医学部,市场部,呼叫中心,数字化等)的业务涉及到药物警戒工作,则体系的各个元素应考虑纳入对相关部门和流程的管理。如,审阅相关流程以确保不良事件的收集和报告,内审活动包括相关部门的流程和人员;
质量管理体系应是一个有机的整体。从产品生命周期来看,组织往往会有不同的质量管理体系以精细管理和适应不同的部门和活动。例如GLP,GCP,GVP和GMP等。这些不同的体系,因为所涉及的部门、人员和流程不同,其内容和管理方式也有差异。例如,在SOP更新方面,基于需求,有的体系可能要求年度审阅,有的可能是两年一次。而从常规质量管理体系的角度看,所有的体系都有质量管理体系基本元素,都遵循通用的基本原则和类似甚至一样的管理理念和工具,比如“基于风险的思维”。
由此可见,各个体系服务于产品不同的生命周期,彼此影响。同时,各个体系都在整个组织的体系框架下运行,共同为组织的发展和质量目标服务。因此,一个好的质量管理体系,还应适应组织整体的发展目标和策略,考虑其他质量体系的特点从而确保整体的有机和协调。例如,组织可以定义GxP层面的质量管理体系框架和基本要求。在此基础上,各个领域(如GLP, GCP, GVP, GMP等)设计适合自己的质量管理体系。
总之,建立一个适合组织发展的、高效的质量管理体系,能提供进行持续改进的框架,提高组织整体绩效和竞争力,从而不断满足患者和医疗市场的需求。
法规监管部门检查中质量管理体系的常见发现/问题
在药物警戒检查(Inspection)活动中,质量管理体系是其中比较重要的一个模块。其内容通常包括,制度流程、记录管理,培训及合同,审核及变更管理(包括CAPA),药物警戒体系的监督管理包括药物警戒负责人(QPPV),信息技术系统及应用等。与质量管理体系相关的检查/审核发现项,通常占有较高的比例。因此,组织应高度重视质量管理体系的建设和管理。
从总数看,根据英国药监机构MHRA发布的药物警戒检查年度报告,2009年到2020年期间,质量管理方面的发现项占比约为30%(视不同年度及严重程度,其占比有所浮动),共包括24±个严重缺陷(Critical),488±个主要缺陷(Major)及551±个一般缺陷(Minor)。
从比重看,以MHRA最新发布的2019-2020年度报告为例,质量管理体系相关的缺陷(Critical, Major, Minor)在所有模块分类里排序第二,接近于风险管理,其比重远高于其他模块。
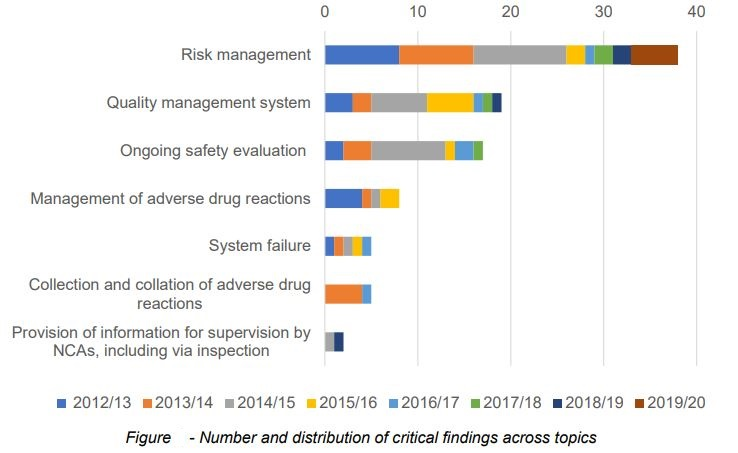
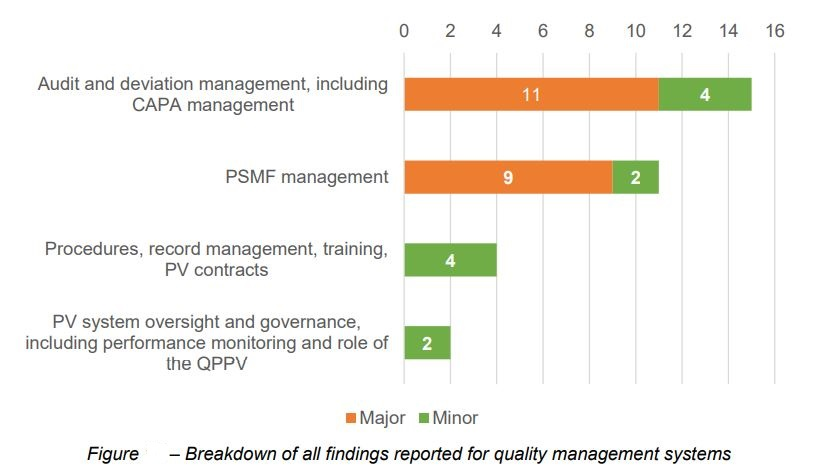
从具体内容看,质量管理体系中,审核及变更管理,包括对CAPA的管理,和药物警戒体系主文件(PSMF)的管理是最容易出问题的。
参考:Pharmacovigilance inspection metrics, 2009 to present: https://www.gov.uk/government/statistics/pharmacovigilance-inspection-metrics-2009-to-present
参考:
NMPA 药物警戒质量管理规范
EMA Guideline on good pharmacovigilance practices (GVP) Module I – Pharmacovigilance systems and their quality systems
MHRA Pharmacovigilance inspection metrics, 2009 to present
药物警戒质量管理体系的核心模块及内容,比如委托管理,内审,以及药监检查准备,CQAF PV Sub-committee后续会以专题的形式为你带来更多思考和借鉴,敬请期待。
作者| 刘建昌 张兰晶
审阅|吴奕卿 于桂琴
CQAF PV Sub-committee

 沪公网安备 31011202013414号
沪公网安备 31011202013414号