临床研究协调员(CRC)是研究者团队的重要一员,实践中,由第三方组织(SMO)委派CRC到临床试验机构支持主要研究者(PI)承接的临床试验已成为大多数试验的标配。
基于行业的一些常见问题,CQAF核心组在会员内开展了调研*,并邀请资深CRC, 机构办 ,PI ,律师和GCP QA 代表就如下方面展开了研讨:
Ø 若CRC来自SMO, 谁应该和SMO 签合同,申办方还是临床研究机构?
Ø 作为第三方的员工,CRC可否被授权进入临床试验机构病历管理系统(HIS),并协助PI进行HIS查询和潜在受试者的筛选?
Ø 一方面看到CRC的工作不可或缺,另一方面从临床研究记录中却少见CRC产生的记录(即有CRC签字的记录),不做隐形者,如实呈现实际发生,各方可以做什么?
本通讯,在汇总各方研讨意见的基础上,作如下总结,供业内尤其是QA专业人士参考。
1. 合同:明确SMO应该与临床试验机构(医院)签合同,可以是两方合同,也可以是三方合同(增加申办者)。如果只有SMO与申办者的合同,需要评估潜在的风险。
CRC是研究团队的一员。SMO 作为人力资源提供方,不应参与到临床试验的具体工作中(如研究项目管理),除非合同另有规定并符合GCP的原则。
作为CRC服务的财务赞助方,申办方应在相应的合同中明确与SMO、 临床研究机构就CRC服务方面的责、权、利。监查或稽查中发现的临床试验执行问题包括CRC工作相关的)应与PI沟通,若适用,上报给相应的临床试验机构和/或伦理委员会。
2. 授权CRC进入医院患者数据库查询并筛选潜在的受试者:实践中需要CRC协助PI查询数据库,筛选潜在受试者,若CRC来自第三方SMO, QA在稽查的过程中应关注CRC是否被合理授权进行数据查询;CRC是否遵照规定,查询的数据仅分享给临床中心的研究者;临床试验机构否对这部分工作有监管等。
从法务的角度,患者的健康信息属个人隐私,对这部分信息的使用应确保充分知情,和专事专用。CRC 在合理授权的情况下,协助PI进行数据查询,查询的数据不可分享给临床研究团队以外任何个人和组织。
从机构管理的角度,在遵守上面基本原则(授权,保密,专事专用,知情等)的前提下,与会专家也分享了最佳实践,如:
对健康受试者:在潜在受试者(志愿者)已被告知的前提下,CRC可以查询相关信息,协助研究者进行招募工作。
对于患者参与的临床试验:研究型的临床机构可以考虑在院内推行“泛知情同意”模式,即如果患者有意愿参与未来的临床试验,同意院方查询其在本院的医疗数据,用于受试者的筛选。
授权CRC只读账号,登陆医院患者数据库系统进行查询 (比如将HIS系统数据脱敏),并确保仅在院内使用。
3. CRC的工作记录:这个话题也是行业内讨论很多的话题,QA稽查中首先应了解CRC具体承担了哪些工作,不仅基于授权,还基于实际的流程等,然后评估CRC是否有相应的资质和培训,譬如:
医学判断或临床决策:不可。必须由有资质并被授权的临床医生承担。
护理、药物管理:不可。行业内CRC多是护理或药学学历,但根据医疗机构从业规定,只有在所属医疗机构注册的护士才能从事护理工作,这种情况下CRC就没有相应的资质为受试者提供常规护理(抽血,打针等);同样的情况也适用于中心化药房的药品管理工作。
CRC可承担的工作:如随访安排,(电话)随访信息收集,标本的预处理等工作。对于这些工作,稽查中应评估PI的授权,CRC接受的培训;评估CRC是否如实记录其所承担的工作;评估CRC与研究者的沟通,就受试者的健康状况是否及时跟进研究者,以确保研究者做出及时的临床评估与处置。
确保CRC的合理授权,如实记录,需要临床机构为CRC的工作提供相应的条件,就此,与会专家分享了一些最佳实践,如:
临床机构原始记录系统的搭建:在HIS 系统的基础上,建立临床研究记录系统(符合GCP标准的),并给予CRC相应的登录权限。
临床研究开始前,明确记录各源数据的源文件表单(source data identification log),对于CRC没有条件使用电子系统进行记录的情况,应提前定义并确保纸质和电子记录均符合ALCOA(可溯源的、清晰的、同步记录的、原始的、准确的)原则。CRC作为临床研究团队的重要一员,其工作合理、有效的开展,需要主要研究者、临床研究机构、SMO和申办方各司其职,做对的事情,从而确保临床研究的高质量,可持续发展。
就此,与会专家提出如下倡议/最佳实践分享:
临床试验机构应更多更全面地了解临床试验一线工作的问题,为CRC提供相应的工作条件,监督CRC的授权情况以及在临床试验中的实际履职,并对PI的工作建立相关的奖惩制度。
PI应回到临床试验在机构执行的主导性角色上;作为第一责任人,PI 应监督助理研究者、研究护士、研究药师、CRC等如实履行临床研究授权中的职责。
质量源于设计,申办方应在研究中心筛选时做好风险评估,确保过程中的质量管理以及问题管理。
CRC是研究者团队成员,SMO 不是。明确责、权、利,确保个人信息和受试者权利保护。
进一步探讨CRC与研究机构的雇佣模式,以实现临床试验在机构高效、便捷、合规的执行。
后附调研*问卷结果,感谢参与调研的会员。
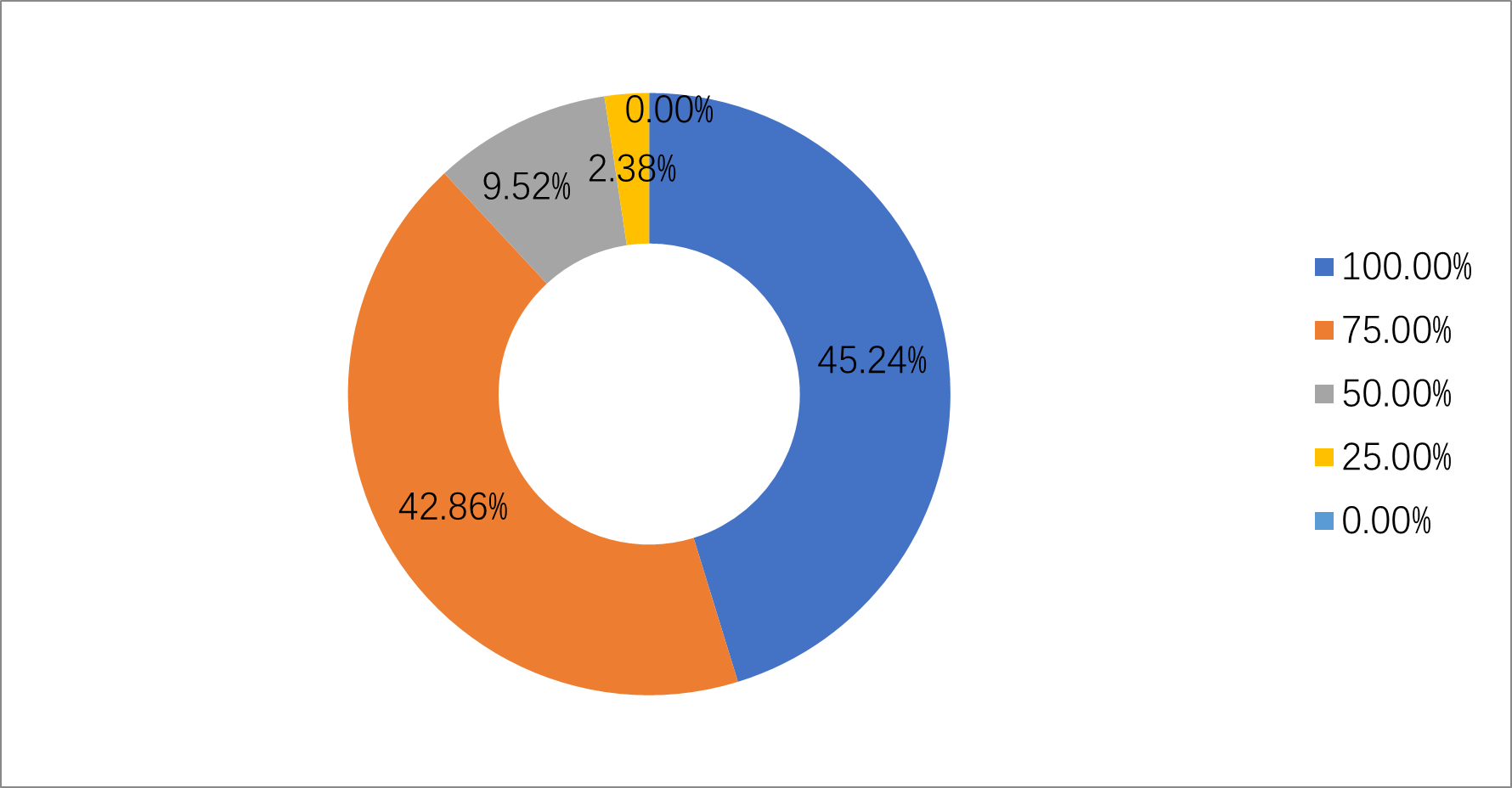
1. 从42份调查问卷的结果可以看到(图1),有45.2%的人认为现今的临床试验对CRC的依赖程度是100%;42.7%的人认为现今的临床试验对CRC的依赖程度是75%;有9.5%的人认为现今的临床试验对CRC的依赖程度是50%;只有2.4%的人认为现今的临床试验对CRC的依赖程度是25%。
图1 您认为现今的临床试验对CRC的依赖程度如何?(单选)
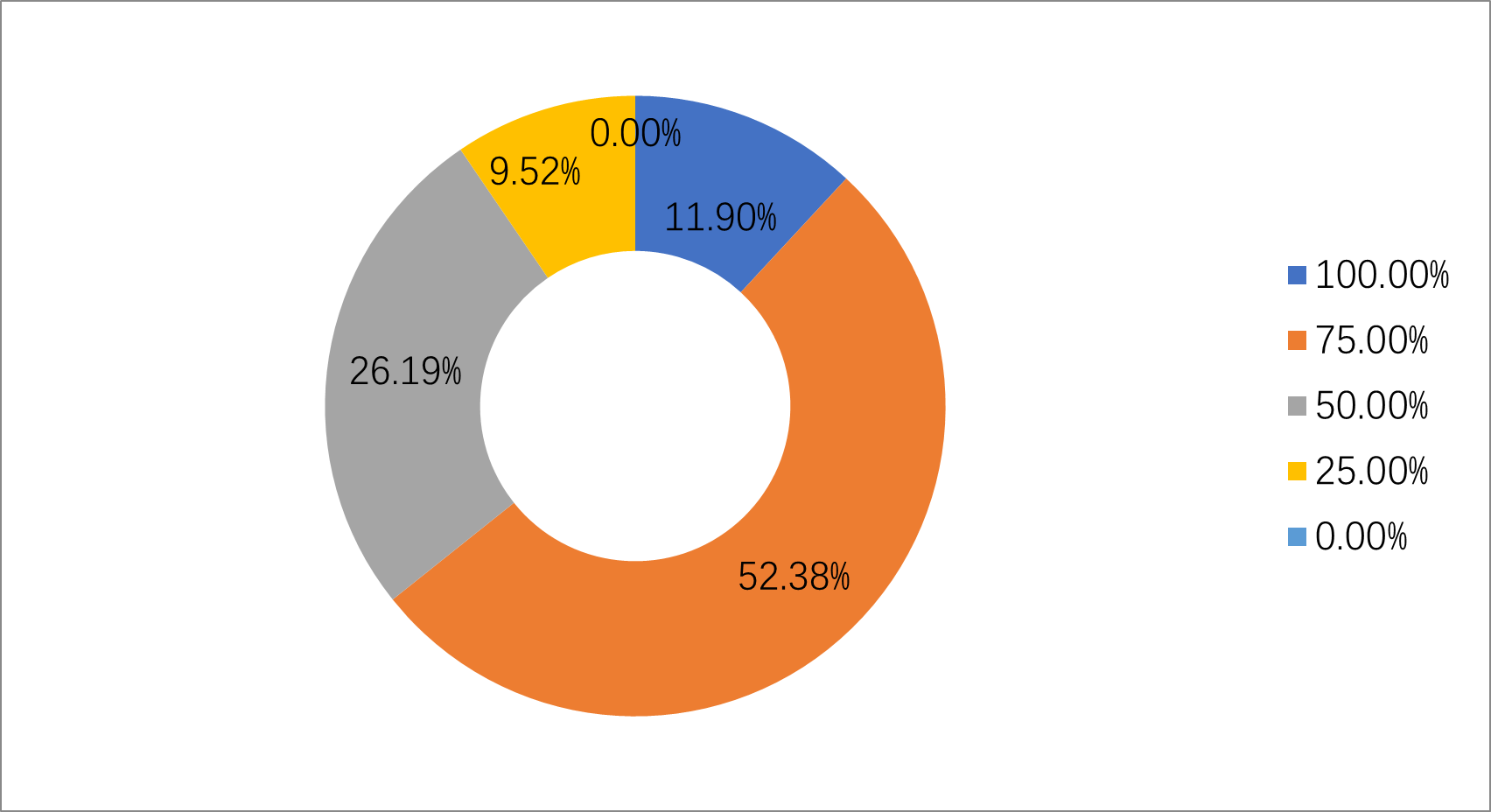
2. 从42份调查问卷的结果可以看到(图2),有11.9%的人认为现今的临床试验中100%的试验或多或少会出现CRC代替研究者行使职责的现象;52.4%的人认为现今的临床试验中75%的试验或多或少会出现CRC代替研究者行使职责的现象;有26.2%的人认为现今的临床试验中50%的试验或多或少会出现CRC代替研究者行使职责的现象;只有9.5%的人认为现今的临床试验中25%的试验或多或少会出现CRC代替研究者行使职责的现象。
图2 根据您的观察,现今的临床试验中有多少比例的试验或多或少会出现CRC代替研究者行使职责的现象?(单选)
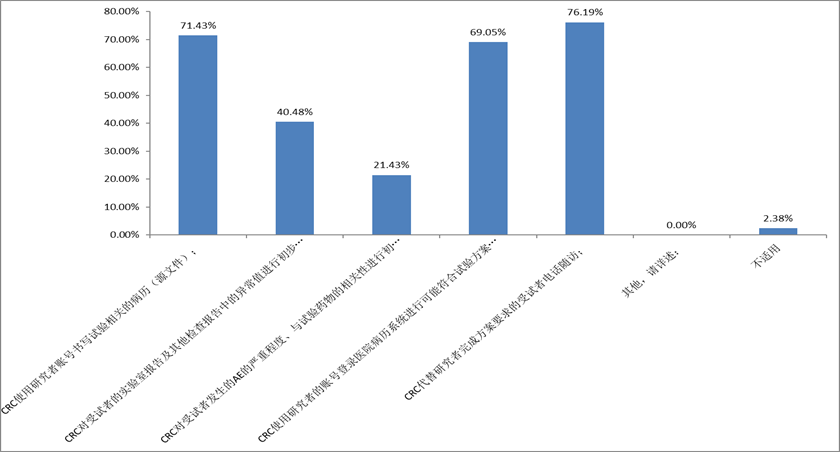
3. 从42份调查问卷的结果可以看到(图3),有76.2%的人认为CRC代替研究者完成研究方案要求的电话随访工作;有71.4%的人认为CRC使用研究者账号书写试验相关的病例;有69.1%的人认为CRC使用研究者的账号登录医院病历系统进行可能符合试验方案的病人查询,并联络病人来院参加筛选。
图3 以下选项中哪些是现今临床试验中最常见的CRC代替研究者行使职责的现象?
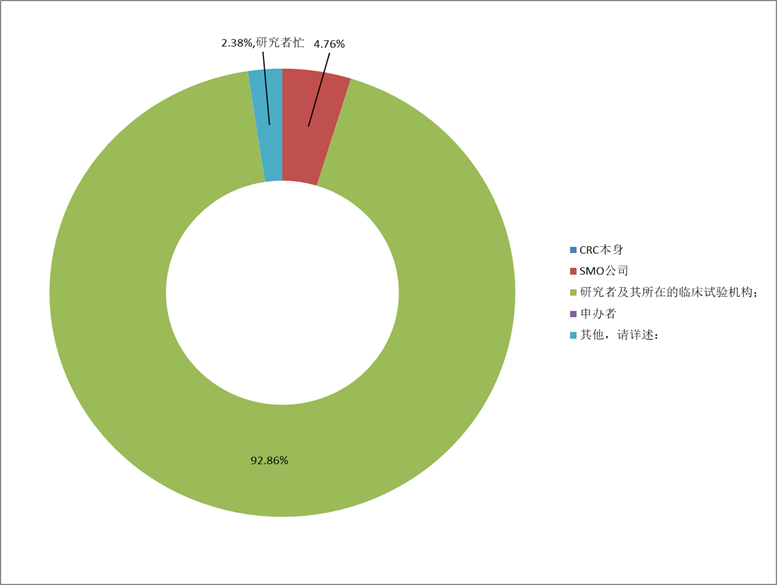
4. 从42份调查问卷的结果可以看到(图4),接近93%的人认为研究者及其所在研究机构是造成CRC代替研究者行使某些职责的根本原因;4.8%的人认为SMO公司是造成CRC代替研究者行使某些职责的根本原因;而认为CRC或申办方是造成CRC代替研究者行使某些职责的根本原因的均为0%。
图4 您认为造成CRC代替研究者行使某些职责的根本原因应归因于(单选)
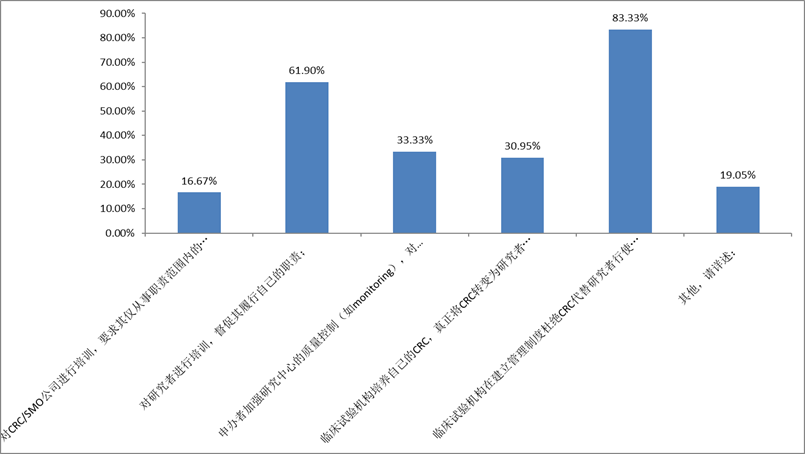
5. 从42份调查问卷的结果可以看到(图5),有83.3%的人认为临床试验机构应建立管理制度杜绝CRC代替研究者行使某些职责能够有效解决这一问题;有61.9%的人认为应对研究者进行培训,督促其履行自己的职责能够有效解决CRC代替研究者行使某些职责。
图5 您认为以下方案能够有效解决CRC代替研究者行使某些职责的是
最后,借此再次感谢以下讨论嘉宾以及参与话题组织、主持、审阅的CQAF核心组成员:
徐晓刚 CQAF核心组成员
周立萍 CQAF核心组成员
沈一峰 上海市精神卫生中心 主任医师 机构办公室主任
贺晴 无锡市人民医院 主任药师、硕士研究生导师
葛永彬 中伦律师事务所高级合伙人
高松 圣兰格(北京)医药科技开发有限公司 高级质量与培训经理
刘清月 徕博科 临床质量保证部亚太区负责人(印度除外)

作者︱王峰松,周立萍
编辑︱王峰松
审阅︱陈华,高松,葛永彬,贺晴,刘清月,沈一峰,于桂琴,周立萍

 沪公网安备 31011202013414号
沪公网安备 31011202013414号