The CQAF 2023 annual meeting, the first onsite meeting after the pandemic, was held in the Shanghai office of MSD on 20 Jun. Around 80 CQAF members from global and local pharmaceutical companies and CROs joined this conference. The GCP and GLP experts and speakers walked the audiences through the three hot topics of “The revisions and changes of E6R3”,“Key points of inspection and common issues – inspection readiness of lab and the solutions to the common issues”and “The QA’s insight and consideration to the clinical trial common issues based on the key points of inspection”, based on the real cases and the pre-defined questionnaire results.
CQAF2023年年会在6 月 20 日在默沙东上海办公室召开,这是疫情之后的首次线下会议。大约有80位来自申办方和CRO的会员参加了此次盛会。GCP和GLP的专家和讲者带领听众通过实际案例和预先设置的调查问卷结果对“E6R3的修订变化和与未来与Quality相关的工作考量”和“核查要点及常见问题分享 -- 探讨实验室核查准备及常见问题的解决”和“结合核查要点,就目前临床试验常见问题的QA视角与思考”三个话题进行了讨论互动。

话题1:ICH E6R3的修订变化和与未来与Quality相关的工作考量
张萍老师(阿斯利康全球研发质量保证亚太区负责人、CQAF核心成员、ICH E6 R3 全球专家组成员)向参会的会员们介绍了GCP变革的背景和趋势、最新进展。并深入浅出地介绍了ICH E6 GCP R3 原则和附件1的主要变化。与ICH E6(R2)相比,R3变化较大的章节是GCP原则、附件1中的研究者、申办者和新增的数据管理 (适用于研究者和申办者)章节、术语以及附录 C(临床试验实施的必备文件)。她同时强调了理解GCP 变革的目的和趋势的重要性,如
R3旨在鼓励创新,提高研发效率,并增加患者/参与者参加临床试验的便利性。
R3在提供灵活性,减少负担的同时,强调相称性,以确保参与者的安全和临床试验结果的可靠性。
基于以上,R3提到的高频词包括:相称性、根据实际需要/具体情况、行动符合目的 (参与者的安全和临床试验结果的可靠性)。
在接下来的分组讨论环节,各小组代表分享了对E6 GCP 变革初步反馈和思考。普遍的反馈是认为R3在很多方面给予了更详实的指导并保留了灵活性,比如研究中心人员的授权和培训、知情同意、基于关键质量因素的风险管理,和对监查(monitoring)的要求等。另一方面,还有一些需要进一步理解,观察,澄清, 或落地可能存在挑战的地方,比如如何做到相称性,监管对相称性,灵活性的接受尺度如何?以及对临床试验中心的计算机化系统的相关要求等。GCP变革的前景值得期待,我们也认识到变革的过程的渐进和应对各种挑战也是必经之路,与会会员们纷纷表示需要跟进学习,同时持续地进行自身和组织的能力建设。大家也希望未来通过CQAF和相关的专业平台能够有R3实施相关的指导和专题培训。
话题2:核查要点及常见问题分享(实验室部分)-- 探讨实验室核查准备及常见问题的解决
CLQA作为CQAF的GCLP subcommittee在本次年会中剖析了药品注册核查要点与判定原则中实验室(中心实验室和生物分析实验室)的具体要求以及分享了过往核查中常见问题。较“722”初始阶段核查常见数据真实性问题(如选择性使用数据或者无理由弃用数据等),现阶段核查常见的问题更多集中在核查要点、方法验证、样本分析方案及SOP等的合规性问题,如样本流及数据流溯源部分信息不足、实验室结果报告超过和申办者约定的TAT、方法学验证报告未递交、样本处理离心机离心力与方案中要求的不一致、无样本温度计的问题等。在讲者分享了相关信息后,实验室和申办者代表就几个常见问题进行了更深一步的讨论,致力于双方能更好的在核查过程中解决这些问题,避免/减少核查发现项,使得药物能够更早的上市。其中对于离心机转速/离心力对于检测指标到底有多大影响做了深入的讨论。离心的目的是得到检测所需样本,如血清、血浆等,一般情况下稍微偏离方案中规定的转速/离心力对于血清、血浆样本的质量影响不大,但是过低的离心力可能造成血细胞与血清/血浆分离不完全、过高的离心力可能破坏血细胞,从而影响样本质量造成最终的检测指标不准确 (如PT、APTT等)。研究中心应该按照试验方案/实验室手册规定进行离心处理,如果未满足离心条件,申办者应与实验室一起对于不同检测指标的影响进行评估。
话题3:结合核查要点,就目前临床试验常见问题的QA视角与思考
来自拜耳、维昇药业、默沙东的讲者分享了“结合核查要点,就目前临床试验常见问题的QA视角与思考”的话题。来自拜耳的讲者石爱琳女士介绍了讨论本话题的初衷,结合核查要点回顾并分析了近两年药物临床试验数据核查中的主要发现项,以及行业内临床试验质量管理中的常见问题与痛点。内容涉及原始病历记录、 安全性信息记录、合并用药记录、方案偏离、试验用药记录、量表的填写与修改等方面。在会前,为本话题发起的收集业界声音的问卷调查,收到了来自外资药厂、内资企业、CRO、研究中心人员等许多临床试验从业者的回复,感谢大家的反馈与具体痛点的分享。两小时的话题,从质量管理的角度,通过具体案例,多方面深度剖析痛点背后的原因以及对行业未来的展望。
在案例讨论环节,来自维昇药业的讲者朱慧玲女士引导大家就“问卷/量表的修改”如何定性,如何整改进行了深入而热烈的讨论。随着“以患者为中心”的理念的推进,“患者报告结局(PRO)”在临床试验中的使用和用途也越来越受到重视,由此引发的问题和考量也越来越多。经过了热烈的讨论,大家一致认为“问卷/量表的修改”是目前一个非常值得关注的问题,如何定性需要深究引起修改的根本原因,并根据根本原因提出相应的整改措施。如果使用电子患者报告结局(ePRO),通过技术手段,对类似的问题可以有一定程度上的规避,比如权限设置,ePRO数据与EDC系统连接等。本案例分析的特邀嘉宾于桂琴女士对大家的讨论给与了肯定,也给出了实操性的建议,问题的定性需要全面深入的调查,而到底采用纸质PRO还是ePRO最终要取决于方案设计。
经过“问卷”话题的预热,来自默沙东的讲者温冰女士将大家带入到了第二个行业痛点:源文件的头脑风暴中。与会的小伙伴们在讲者的带领下就源数据/源文件的ALCOA原则,电子病历系统管理,及源数据定义等问题各抒己见,并就一些具体问题,如回溯性补充或修改,外院病史的收集,电子病历系统的使用和管理,电子记录与纸质记录的使用等进行了深入的剖析。大家一致认为,源文件的问题目前是行业普遍存在的痛点,如何改进需要业界同仁共同思考,并不断进行完善;电子病历系统的使用和管理目前是临床试验中的高风险区域,应充分重视。其管理不仅要适用于临床试验的需要,也需要符合国家对于电子病历系统管理的一般法规原则。本环节的特邀嘉宾周立萍女士(默沙东研发亚太区质量保证部高级总监)对大家的讨论进行了肯定,并给大家指引了更明确的思考方向,回归源文件的本源定义,充分理解相关的基本概念,真正运用cQMS的各种元素,保证临床试验质量和患者权益。
在整个年会的最后一部分,2022年CQAF年度奖项相继揭晓。获奖团队和个人也接受了在场会员们的掌声祝福。
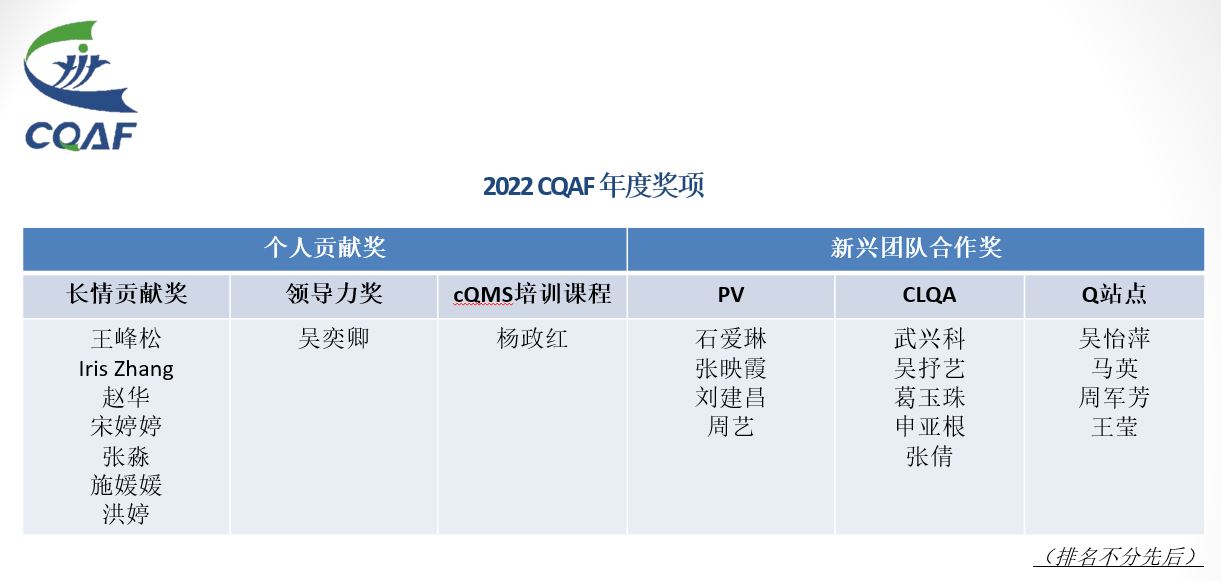
最后,借此再次感谢以下几位讲者和讨论嘉宾:
张萍 | 阿斯利康全球研发质量保证亚太区负责人 |
顾晓慧 | 辉瑞制药 质量保证部 药政检查管理 总监 |
郑丽丽 | 徕博科 生物分析实验室 质量经理 |
申亚根 | 观合医药 质量副总监 |
陆璐 | 华领医药 GCLP/GLP 高级质量保证经理 |
朱佳佳 | 罗氏(中国)投资有限公司 Senior Quality Lead CLQA 核心组成员 |
石爱琳 | 拜耳医药研发 质量保证稽查中国团队负责人 |
朱慧玲 | 维昇药业(上海)有限公司 质量保证负责人 |
温冰 | 默沙东研发 临床研发质量保证副总监 |
We warmly welcome you to join us to propose hot topics and/or volunteer or recommend speakers for future CQAF quarterly meetings. Please don’t hesitate to contribute your thoughts via the following link or QR code:
我们热烈欢迎您加入我们,为未来的CQAF季度会议提出热点话题和/或志愿者或推荐讲者。请不要犹豫,通过以下链接或二维码提供您的想法:

作者︱吴怡萍,刘艳萍,石爱琳,王峰松
编辑︱王峰松
审阅︱徐晓刚,张萍
关于上述的分享PPT,请登陆会员账户,点击下方第二页。

 沪公网安备 31011202013414号
沪公网安备 31011202013414号