“DIA中国GCP现场核查 - 从自查到核查的管理研讨班”于11月6-7日在北京举行。针对申办方/合同研究组织(CRO)的质量相关工作人员(包括稽查员、质量经理、核查经理等)、药物临床试验机构工作人员以及研究者,由中国质量保证论坛(CQAF)的多位专家结合多年的国内外QA 领域工作经验,亲自设计课程、 讲解与带队练习,并邀请海外及药监领域专家现身说法。
研讨班希望能让学员理解CFDA实施药物临床试验数据核查的全流程与总体要求,掌握一些适用于准备阶段与核查现场的实用技巧、工具,掌握回复核查不合格项目的要点,了解其他主要药政机构实施现场核查的流程与要求。由多位接受过多次美国FDA、CFDA检查的讲师分享,带来他们的一手经验和感受。此外,有些嘉宾还经常登台授课,语言表达能力极强,能清晰简洁传递知识与经验,同时也充满个人魅力。在带来知识分享的同时,还有语言艺术的享受。

活动伊始,组会委动员全部学员写下自己在本次活动中最希望学习到的内容并进行了分类,以便于更有针对性且有效的进行授课。


周丽萍,默沙东研发(中国)有限公司亚太区质量保证总监
作为本次培训的组委会主席,立萍介绍了本次研讨会的设计初衷及主要涵盖内容

王佳楠,CFDA审核查验中心研究核查处副处长
王佳楠处长从我国临床试验工作程序、临床试验核查要点及核查中的常见问题三个方面首先与参会者们进行了分享。丰富的实例分享让参会者意犹未尽,获益良多。

陈华, 强生公司质量策略亚太总监
陈华总监从自查前需要考虑的问题着手,就是否需要进行re-SDV, re-SDV前的沟通、如何汇总及解决自查中发现的问题等申办者自查的策略方面与参会者进行了分享。陈华强调为避免盲目的re-SDV, 在决定re-SDV前需要考虑的风险因素包括:


Ching Tsu LIN (左), 武田临床质量保证高级项目经理
洪婷 (右), GSK临床质量保证资深顾问
第一天下午课程内容正式进入到现场核查的准备阶段,Ching和洪婷带领学员依次从大名单阶段 – 每月现场核查计划公告 – 接到正式核查通知 三个阶段所需要了解掌握的要点进行了阐述。
在大名单阶段,核查项目负责人需要拟定详细周全的核查准备计划,基于风险评估妥善进行资源分配并及时沟通。而组建“黄金战队”则更是这个阶段的重中之重,为战队成员制定培训计划、进行人力评估及任务分配、检查前访视计划及协调后勤物资等都对项目负责人的全盘视角及把控能力提出了极高的要求。
通知可能被核查单位,定期更新准备进度、及时沟通、调整所需资源以及准备开场简报则是进入每月现场核查计划公告阶段的主要考量。
当接到正式的核查通知后,核查前访视、统计和DM相关报告准备及核查模拟练习可以大大提升成员信心,熟悉核查流程。

刘海涛 (上),辉瑞(中国)研究开发有限公司质量保证中国策略主管;中国质量保证论坛(CQAF) 现任主席
顾晓慧(左下),辉瑞(中国)研究开发有限公司 药政检查管理高级经理
孙晔 (右下),百时美施贵宝全球质量保证亚太区全球合规专家
如果说核查准备是现场核查战役中的“粮草先行”,那么由海涛、顾晓慧和孙晔三位老师领衔的核查接待则是直面检查员的“正面战场”。
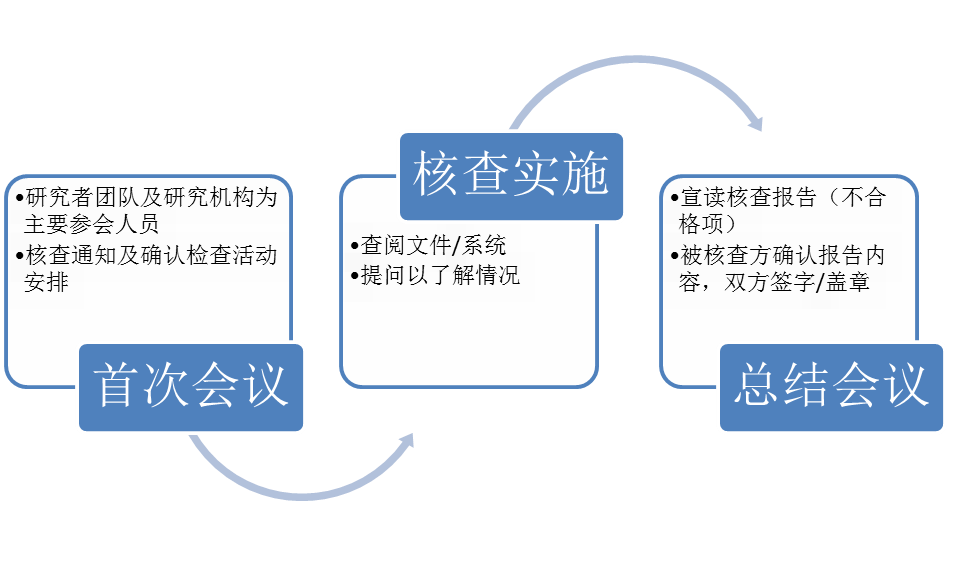
在核查实施的现场环节中,需要将团队的成员分派到核查房间、支持房间和远程协三组,最恰当的安排可以确保关键性问题能有合适的人员及时准确地回复。当两到三组核查同时进行时,最佳人员的调配对Inspection Team Lead是一项严峻的挑战,团队中的各个成员则需要运用最有效的沟通方式(WebEx, F2F, Tel, email, & other mess media etc.)进行准确高效的交流。
三位老师还就如何应对现场问题、要求及相应记录、核查每日汇总和问题澄清等内容作了详细的解释,通过小组讨论和角色扮演加深了参会者对各项要点的记忆。

现场老师与学员互动演绎如何应对inspector要求提供试验的监查报告
当核查现场告一段落,并不意味着这场没有硝烟的战争落下帷幕,核查发现的回复同样意义重大,其终极目标是及时获得NDA批准。

Ellyne、蒋燕敏和刘清月老师带领参会者就核查发现的含义、核查发现回复期间需要考虑的重要事项、如何与研究者和GCP office协同工作以最终实现双赢,以及举行CFDI-申办者沟通会等内容进行了详细的探讨。
至此为止,一个从核查准备、核查接待到核查回复的全周期现场核查才最终完成。

Ellyne SETIAWAN(左),勃林格殷格翰医学质量负责人
刘清月(中),罗氏全球药品开发中心质量部资深GCP战略负责人
蒋燕敏(右),赛诺菲中国及亚太区研发中心质量运营负责人
培训的最后,来自美国MSD质量保证部的Deb Driscoll和Priya Chaturvedi博士从全球的视角对核查和CAPA管理进行了综述,并分享了核查成功的秘诀: 透明度和可见性、风险缓解和响应以及持续改进。数据的完整性、可靠性以及可溯源性则是贯穿始终的不可逾越的底线。

Deb Driscoll (上),默克研究实验室质量保证副总裁
Priya Chaturvedi博士(下),默克研究实验室质量保证执行总监

学员小组讨论和现场互动
为了准备好本次培训,全体老师们不断开会讨论,抠细节,给参会者带去最有干货的分享。
欢迎长按下面二维码加入DIA GCP Inspection群,我们将不定期发起相关话题并邀请大家参与讨论,有机会将您的分享发表在DIA订阅号,并赢取大奖。

 沪公网安备 31011202013414号
沪公网安备 31011202013414号