
作者信息:Febe Chen(陈凤菊) 江苏恒瑞医药股份有限公司,拥有16年行业经验,曾任职药监部门检查员3年,具有迎接美国FDA对申办方/CRO和临床研究中心检查的经验
指导人:Emma Hu(胡娟)
1977年美国FDA设立的生物研究监测项目(Bioresearch Monitoring Program, BIMO)是一项旨在对非临床和临床研究的实施和报告的各个方面进行监管的综合项目,保护受试者的安全和权益,确保新产品注册申请所递交数据的质量和完整性,并监督公司遵守上市后要求。BIMO GCP检查主体主要包括:
临床研究者
申办者
申办-研究者
合同研究组织
伦理委员会
BIMO实施GCP检查的法规依据:美国联邦法规GCP相关的章节
BIMO实施GCP检查检查员遵循的《合规项目手册》
7348.003 体内生物利用度/生物等效性项目-临床部分
7348.004 体内生物利用度/生物等效性项目-分析检测部分
7348.809 伦理委员会
7348.810 申办者和合同研究组织
7348.811 研究者和申办-研究者


BIMO GCP检查流程

1. 检查任务发起
美国FDA下属药品评价与研究中心(Center for Drug Evaluation and Research, CDER)和生物制品评价与研究中心(Center for Bio-logics Evaluation and Research, CBER)根据注册申报材料基于风险发起检查任务,美国本土的检查任务通过监管事务办公室(Office of Regulatory Affairs, ORA)BIMO办公室总部分配给合适的分部,美国本土以外的检查任务直接发送给ORA BIMO办公室总部组织执行。
BIMO适用于FDA的6个中心(CBER, CDER, CDRH, CFSAN, CTP, CVM)和ORA,本文涉及的CDER、CBER和ORA在FDA组织架构中位置如下图所示:
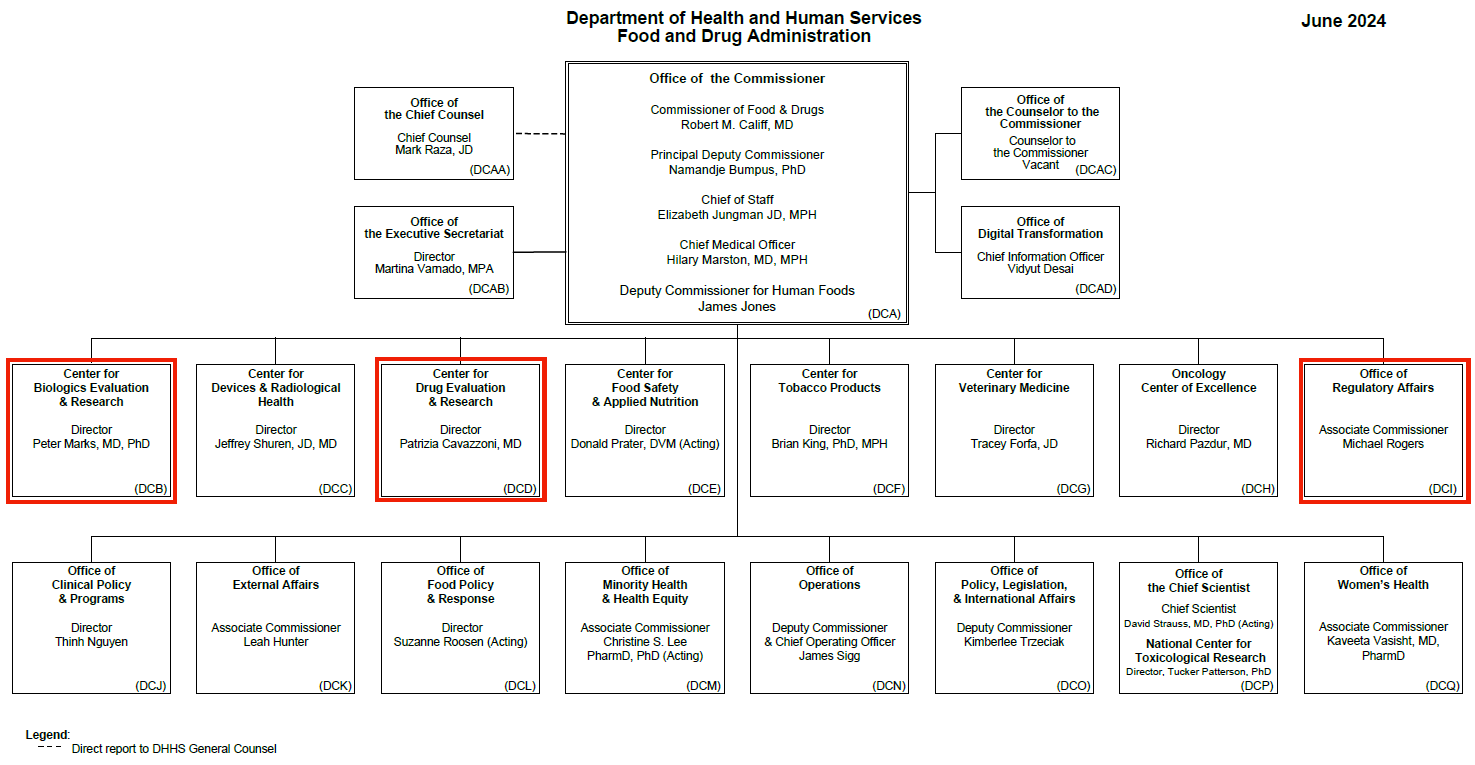
CDRH:Center for Devices & Radiological Health,设备和放射健康中心
CFSAN:Center for Food Safety & Applied Nutrition,食品安全与应用营养中心
CTP:Center for Tobacco Products,烟草制品中心
CVM:Center for Veterinary Medicine,兽药中心
2. 检查通知
现场检查前,中心(下文“中心”均指CDER/CBER)生成检查任务,指派联系人,并在eNSpect系统中签发任务。ORA检查员联系中心的联系人讨论检查事项,并可能安排检查前会议,对复杂的产品或研究、数据问题、独特或紧急情况、合规历史、检查的目的、任何特殊指示或附加信息进行讨论,参会人员可能包括:中心联系人和其他中心人员(如适用)、中心审评部门的主要审评员、审评组长以及其他合适的审评员、负责现场检查的ORA检查员和检查员的上级主管、其他ORA BIMO办公室部门管理人员或总部工作人员(如适用)、外国监管机构(如适用)。
除非特殊原因,BIMO的现场检查通常提前通知被检查单位,提前通知的时间不等,《合规项目手册》有明确说明的时间是不少于5个日历日,但是对于美国本土以外的检查,大多会提前4-6周。
3. 现场检查
一般为3-5个工作日,但FDA官方发布的警告信显示存在检查持续20个日历日的情况。
现场检查的形式一般包括查阅数据和文件、流程演示、电子系统演示、访谈、实地巡查。检查员在现场通常严格遵循BIMO《合规项目手册》中要求,使用自带的U盘收集被检查单位的资料,例如:组织架构图、标准操作规程(SOP)清单、参与研究人员清单、中心和项目情况介绍PPT、研究者近5年项目清单等。
检查期间,ORA检查员会与中心联系人保持密切沟通,例如发生如下情况时:有新的重要信息、检查范围发生变化、需要建议或澄清检查任务、发现了值得关注的证据。
4. 现场检查结论
检查结束时,当检查员观察到认为可能违反《美国联邦食品、药品和化妆品法案》 (Federal Food, Drug and Cosmetic Act, FD&C)及相关法案的任何情况时,会现场出具FDA 483表格给被检查单位管理人员,并与被检查单位高级管理人员讨论483表格上描述的每个发现项。483表格中所列的问题是基于检查员的判断,并不是FDA现场检查的最终结论。
检查员在检查结束后会及时(不晚于3个工作日)将检查结论的初步总结和483表格中问题(如有)的副本发送给中心联系人。
5. 现场检查问题的回复
483表格的回复不是强制性的,但及时、适当的回复可以帮助被检查单位向FDA展示其对问题的认识和纠正措施,其回复结果会影响检查结论的分类,从而避免更严重的后果。FDA鼓励被检查单位在检查结束后15个工作日内以书面形式回复483表格,并提供纠正措施计划,然后迅速实施该纠正措施计划。中心与ORA BIMO办公室共享被检查单位对483表格的回复。
6. 检查结论
检查报告(Establishment Inspection Report, EIR),包括附件、示例和任何相关沟通文件,是在药品上市申请、常规监督和有因检查(例如:投诉、不合规报告)的决策过程中使用的关键文件,清晰完整地记录所有可能对决策过程产生影响的检查观察结果。报告中包括检查期间主要发现问题的摘要。检查员需在规定时限内完成检查报告,现场通常会告知被检查单位检查报告约4-6个月反馈。
中心会负责综合FDA 483表格、EIR、现场收集的所有证据或文件以及被检查单位做出的任何回复,确定检查结论的最终分类,如下共3种:
无需采取措施(No Action Indicated, NAI):检查员在检查中没有发现违规行为,或者发现违规行为的严重性不会引发监管部门采取任何措施
自愿采取措施(Voluntary Action Indicated, VAI):监管部门不准备采取任何监管措施。检查员在检查过程中发现并记录了违规行为,但是违规行为没有对受试者安全或数据完整性造成严重影响,未触及监管行动的阈值
强制采取措施(Official Action Indicated, OAI):建议采取监督管理措施,检查员在检查过程中发现了影响到受试者安全或数据完整性的重大违规行为。对于GCP现场检查,违规的范围、严重程度或特定模式可能涉及如下发现:
受试者在临床研究者的治疗下将要或已经面临不合理的重大的疾病或损伤风险;或
受试者的权利、福利或安全将受到或已经受到严重损害;或
数据的完整性或可靠性受到损害
当中心对检查结论的分类与ORA BIMO办公室建议的分类不同时,中心会与ORA办公室相关人员协商。当中心最终确定的检查结论分类与ORA BIMO办公室推荐的分类不同时,中心会告知ORA相关人员知晓该变更及变更的原因。最后,中心将会在eNSpect系统中输入最终检查结论分类,并将检查后通信的副本发送给ORA BIMO办公室。
FDA官方网站上创建了合规数据库(Compliance Dashboards>Inspection),公众可查询检查结论。
7. 后续监管措施
对于结论为OAI的检查,中心负责起草、制定和发布所有监管和执法信函。FDA基于检查发现,可能采取如下次序由轻到重的措施:
无标题信函(Untitled Letter, UL),当违规行为未达到警告信的监管严重性阈值时,可以考虑发出无标题信函,这种信函的名称“Untitled Letter”意味着它不包含具体的违规细节,也不涉及对被检查单位的正式处罚,是传达和提供正式通知的方式,是 483表格以上而警告信未满的情况下发布的监管信函。
警告信,当判断临床研究者可以通过具体措施纠正违规行为时(例如,制定并遵守FDA可接受的详细纠正措施计划),并且遵守纠正措施计划很有可能防止将来发生类似或其他违规行为,则可以考虑发出警告信。警告信一般在最终检查结论确定后发出,属于对被检查单位采取的非正式劝告措施,目的在于希望被检查单位能自发地迅速整改,是美国FDA促使被检查单位自发合规的主要手段。
警告信中通常会说明被检查单位对483表格的回复是不充分的,采取的纠正措施计划不足以预防将来类似的违规情况发生,被检查单位收到警告信的15个工作日内,应对信中提到的违规情况进行针对性的书面回复,如果不能充分、迅速地解释违规问题,FDA可能在不再通知的情况下采取监管措施。
启动取消资格程序并给予解释机会的通知(Notice of Initiation of Disqualification Proceeding and Opportunity to Explain, NIDPOE),当检查发现符合OAI标准,且研究者有如下行为:
屡次或故意不遵守21 CFR 312及/或21 CFR 50或56的规定;或
屡次或故意提供虚假信息给FDA或申办者
如果研究者的解释不足以被监管部门接受,官方会出具听证通知(notice of opportunity for hearing, NOOH),经研究者申辩后最终决定是否取消其进行药物注册研究的资质(可查询FDA Debarment list)
拒绝数据
拒绝批准在该机构进行或由IRB审查的新研究
查封研究药物
发布禁令
民事罚款
起诉,根据FD&C法案或其他联邦法规(例如:18 U.S.C. 2、371、1001和1341)进行起诉
还可以采取其他必要行动,例如:同意协议(FDA与被检查单位之间的一种正式协议,详细列出了被检查单位必须采取的具体纠正措施,以及实施这些措施的时间表,还可能包括对未来发展计划的约束或条件,旨在防止违规行为的再次发生)、跟踪检查、终止或暂停适用21 CFR 312的临床研究、提交至其他地方机构采取适当的行动、监管会议(约谈)等。


483表格是沟通现场检查发现问题的起点,被检查单位应给予足够的重视,及时、适当、充分回复,并保持与FDA沟通,避免因回复不充分而导致检查结论的最终分类为OAI,从而引发后续的一系列监管措施。
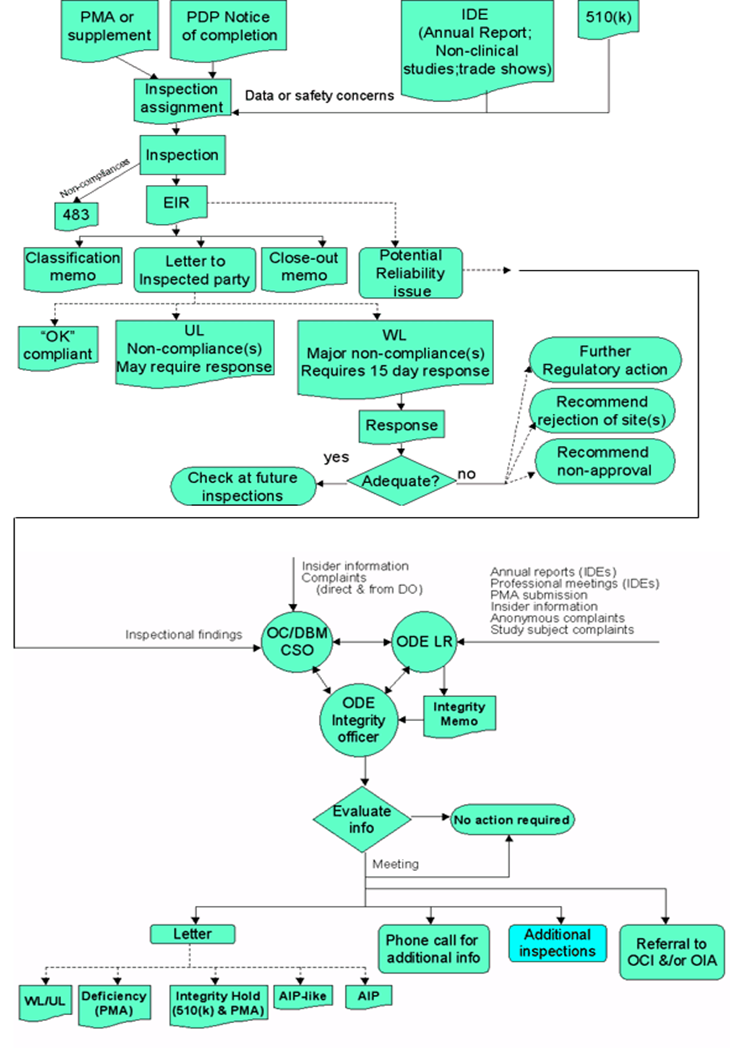
FDA网站BIMO项目关于医疗器械检查的汇总图(如下)清晰展示了483表格后续流程,可供参考理解文中介绍的流程。
参考文件:
[1] 江旻,赵淑华,刘晓红,等. 美国FDA对于研究者药物临床试验现场检查的关注点和发现问题分析,中国新药杂志,2024,33(16):1687-1692
[2] FDA网站相关文件




 沪公网安备 31011202013414号
沪公网安备 31011202013414号